科技日?qǐng)?bào)記者 張夢(mèng)然
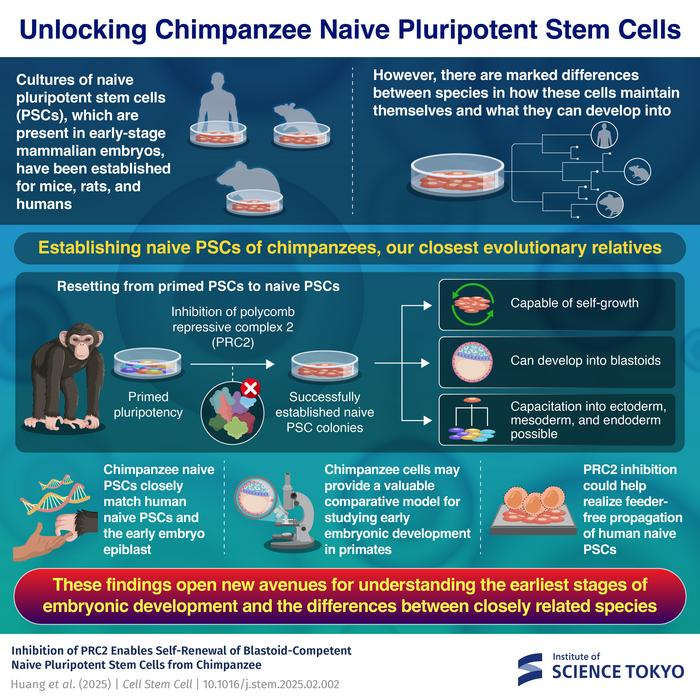
最新一期《細(xì)胞·干細(xì)胞》上發(fā)表一項(xiàng)開(kāi)創(chuàng)性研究稱(chēng):日本東京科學(xué)大學(xué)團(tuán)隊(duì)在黑猩猩體細(xì)胞中建立了原始態(tài)誘導(dǎo)多能干細(xì)胞(iPSC)培養(yǎng)體系。這不僅揭示了維持這些細(xì)胞自我更新能力的關(guān)鍵機(jī)制,而且還首次利用這些細(xì)胞培育出黑猩猩的胚芽細(xì)胞模型,即早期胚胎發(fā)育的模擬結(jié)構(gòu)。這項(xiàng)成果標(biāo)志著對(duì)靈長(zhǎng)類(lèi)動(dòng)物早期胚胎發(fā)育研究邁出了關(guān)鍵一步。
理解細(xì)胞在胚胎早期如何分化,是推動(dòng)再生醫(yī)學(xué)和發(fā)育生物學(xué)發(fā)展的核心問(wèn)題。多能干細(xì)胞(PSC)因具有轉(zhuǎn)化為體內(nèi)各種細(xì)胞類(lèi)型的潛力,所以其在這一領(lǐng)域具有重要價(jià)值。然而,由于倫理和技術(shù)的雙重限制,人類(lèi)及其它靈長(zhǎng)類(lèi)動(dòng)物的相關(guān)研究長(zhǎng)期面臨困境,進(jìn)展緩慢。
相比傳統(tǒng)PSC,原始態(tài)PSC處于更早的發(fā)育階段,具備更強(qiáng)的分化潛能。雖然人類(lèi)原始態(tài)PSC可以同時(shí)形成胚胎組織以及胚外組織(如胎盤(pán)和卵黃囊),但小鼠中的同類(lèi)細(xì)胞卻不具備這種能力。這引發(fā)了科學(xué)界的一個(gè)重要問(wèn)題:這種擴(kuò)展的分化能力究竟是人類(lèi)獨(dú)有的,還是在其它靈長(zhǎng)類(lèi)動(dòng)物中也普遍存在?
此次研究的核心發(fā)現(xiàn)之一是抑制多梳抑制復(fù)合物2(PRC2)——一種調(diào)控基因活性和細(xì)胞分化的關(guān)鍵蛋白復(fù)合體,其對(duì)維持黑猩猩原始態(tài)iPSC的生長(zhǎng)至關(guān)重要。經(jīng)分析發(fā)現(xiàn),即使重編程過(guò)程初步成功,若缺乏對(duì)PRC2的抑制,這些細(xì)胞也無(wú)法持續(xù)增殖。
團(tuán)隊(duì)進(jìn)一步發(fā)現(xiàn),黑猩猩原始態(tài)iPSC在基因表達(dá)模式和分化潛能方面與人類(lèi)細(xì)胞高度相似。它們不僅能分化為胚胎組織,還能生成滋養(yǎng)外胚層和下胚層等兩種至關(guān)重要的胚外組織,而這正是胚胎成功著床和后續(xù)發(fā)育的基礎(chǔ)。基于此,團(tuán)隊(duì)成功構(gòu)建了一個(gè)包含胚胎早期發(fā)育所需全部三種細(xì)胞類(lèi)型的三系胚芽模型。
此外,團(tuán)隊(duì)還在培養(yǎng)系統(tǒng)上取得突破,建立了首個(gè)無(wú)飼養(yǎng)層的黑猩猩原始態(tài)iPSC培養(yǎng)體系。通過(guò)使用PRC2抑制劑,他們成功實(shí)現(xiàn)了黑猩猩iPSC的長(zhǎng)期穩(wěn)定擴(kuò)增,擺脫了對(duì)外源飼養(yǎng)細(xì)胞的依賴(lài)。
總編輯圈點(diǎn)
黑猩猩胚芽模型的建立,為科學(xué)家提供了一種強(qiáng)大的平臺(tái),用于深入探究哺乳動(dòng)物早期胚胎發(fā)育的分子機(jī)制。而隨著該研究不斷深入,這一模型將助力生殖生物學(xué)、疾病建模、藥物篩選及個(gè)性化再生醫(yī)學(xué)的發(fā)展。可以說(shuō),這項(xiàng)成果不僅拓展了我們對(duì)生命最初階段的認(rèn)知邊界,也為未來(lái)靈長(zhǎng)類(lèi)干細(xì)胞研究開(kāi)辟了全新的路徑。